日本ジェネティクスのテクニカルノートとは?
発売したばかりの新製品の性能評価や、既存製品の最適な条件を追求するための条件検討をすることでお客様に心からご納得頂いた上で商品をお使い頂けるよう、様々な評価試験を行っています。
採用前の検討資料として、または採用後の最適条件検討資料としてご活用ください。
また、当データに関するご質問はお気軽にページ下部のフォームよりお問い合わせください。
評価製品:
KAPA Universal Adapter(Cat.No. 9063781001)
KAPA Unique Dual Index Primer Mixes(Cat.No. 9134336001)
KAPA HyperPlus Kit(for illumina)(Cat.No. KK8510/KK8512/KK8514)
目的
KAPA Universal Adapter & UDI Primer MixesとKAPA HyperPlus Kitの組み合わせで
ライブラリー調製が可能かを検証する。
概要
NGSのライブラリー調製において、アダプター試薬はライゲーションベースかPCRベースの試薬が使用される。KAPA Universal Adapter、KAPA Unique Dual Index Primer Mixesは、ターゲットエンリッチメントのプロトコール(KAPA HyperCap Workflow v3.0)で使用されるPCRベースのアダプター試薬である。これまでに、本アダプター試薬をKapa Hyper Plus Kitのプロトコールに則ってKAPA Universal Adapter、KAPA Unique Dual Index Primer Mixesを使用した事例はありません。
本テクニカルノートでは、このPCRベースのアダプター試薬をKAPA Hyper Plus Kitのプロトコールに適応し、ライブラリー調製が可能か実験を行った。その結果、シーケンスを行うのに十分量のライブラリを確保する事ができ、KAPA Hyper Plus Kitのプロトコールでも使用できることを確認できた。
実験方法
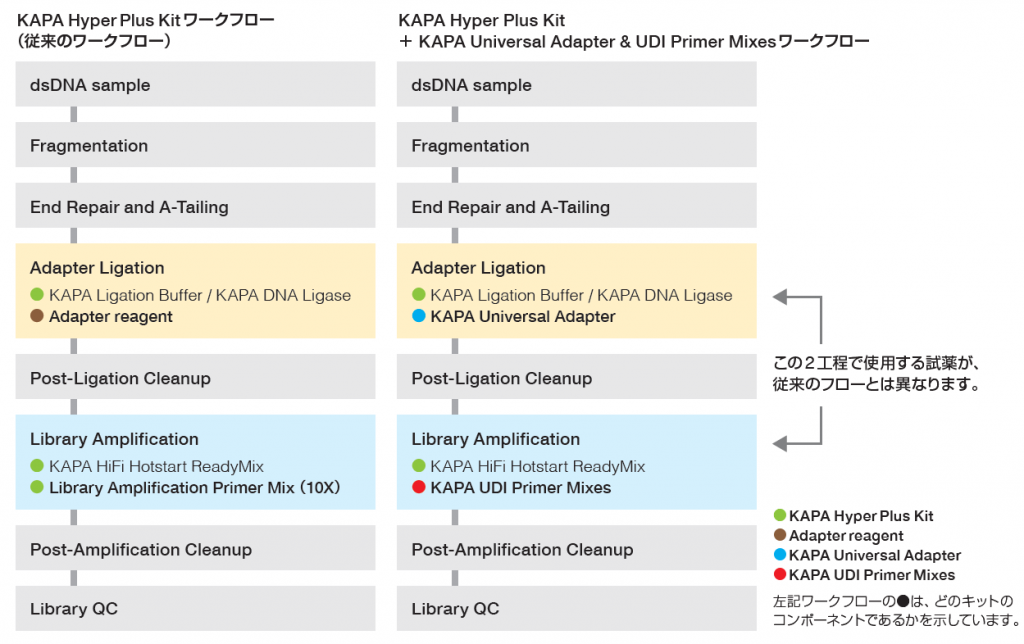
変更される工程の詳細は、『実験方法の補足』を参照
実験条件
| サンプル | : | 菌株由来genome DNA 2 種(北里大学様からご提供いただいたサンプル) |
| DNeasy Blood & Tissue kit(QIAGEN)にて抽出し、アガロース電気泳動でDNAの分解が無い事を確認済 | ||
| ① C. jejuni gDNA | ||
| ② R. equi gDNA | ||
| インプット量 | : | 100 ng |
| アダプター濃度 | : | 15 µM(モル比 アダプター:インサート=100:1) |
| 断片化条件 | : | 37 ℃ 30 分(インサートサイズ 200 bpに設定) |
| PCR cycle | : | 5 cycles |
| 使用プロトコール | : | KAPA HyperPlus Kit KR1145 – v8.21 |
| KAPA HyperCap Workflow v3.0 |
結果:ライブラリーQC
サイズ測定
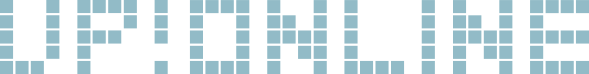
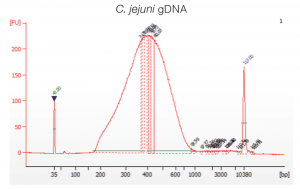
機器: Agilent 2100 バイオアナライザ電気泳動システム (アジレント・テクノロジー株式会社)
試薬:High Sensitivity DNA kit(Chips & Reagents)( Cat. Code:5067-4626 アジレント・テクノロジー株式会社)
濃度測定
| サンプル名 | 濃度 (ng/μL) |
収量(ng) | Ave,Size(bp) | Peak Top(bp) | Molarity(nM) |
|---|---|---|---|---|---|
| C. jejuni gDNA | 50.09 | 1502.8 | 408 | 400 | 198.7 |
| R. equi gDNA | 39.25 | 1177.4 | 389 | 367 | 163.2 |
機器:Light Cycler® 96システム( ロシュ・ダイアグノスティックス株式会社)
試薬:KAPA Library Quantification Kits Illumina/Universal(Cat.No. KK4824)
結果:両サンプルでシーケンスに必要な十分量のライブラリを得る事ができた。
KAPA Universal Adapter & UDI Primer Mixesは、KAPA Hyper Plus Kitのプロトコールで使用できる。
【注意】
- Library Amplification工程にてP5/P7配列およびIndex 配列を付加させるため、PCR freeのアプリケーションを行う場合にはご使用いただく事が出来ません。
- KAPA Universal Adapterは、Full-Length Adapterと同じモル比のプロトコールでライブラリー調製する事が出来ましたが、異なるインプット条件時も同様に使用できるかは、検証、および最適化を行ってからご使用ください。
実験方法の補足
Adapter Ligation 工程
- 以下の試薬のマスターミックスを準備します。
Ligation Master Mix Volume( µL) KAPA Ligation Buffer 30 KAPA DNA Ligase 10 Water 5 Total 45 - 5 µLのKAPA Universal Adapter をサンプルを含むウェルに添加してください。
注)アダプターダイマーの形成を避けるため、Ligation Master Mixを追加する前に、KAPA Universal Adapterを各サンプルに個別に追加する必要があります。 - サンプルと KAPA Universal Adapter を含む各ウェルにLigation Master Mixを 40 µL 添加してください。( 総量 110 µL)
- サンプル溶液を完全に混合し、クイックスピンダウンを行います。
- 以下のプログラムを使用して、サーマルサイクラーで反応させます。 蓋の温度を50℃に設定してください。
Step 温度(℃) 時間(min) サイクル 1 20 15 1 2 4 Hold 1 lid temp 50℃
- インキュベーション後、直ちに次のステップに進んでください。
KAPA UDI Primer Mixes の調製方法
- KAPA UDI Primer Mixesプレートを280 xg, 1分間でプレートをスピンダウンします。
- A1ウェルが左上になるように置き、プレートのホイルカバーを慎重に取り外します。
注)プライマーのクロスコンタミネーションを避けるため、元のホイルカバーは破棄してください。 - マルチチャンネルピペットを使用して、PCR グレードの水を各ウェルの底に10 µL 添加します。
注)必ず都度新しいピペットチップを使用してください。 隣接するウェルに液体が飛散しないようにゆっくりと分注してください。 - 各ウェルに10 µLの水が入っていることを確認し、付属のホイルシールをしっかり貼り付けてください。
- 280 xg で30秒間でプレートをスピンダウンさせ、溶液がウェルの底にあることを確認します。
- プレートをボルテックスし、全てのウェルが十分に混合されていることを確認してください。
- 280 xg、1分間でプレートをスピンダウンしてください。
- 以上の操作で、Library Amplification工程で使用するKAPA UDI Primer Mixesの準備ができました。
- 未使用のKAPA UDI Primer Mixesは、-15 ~ -25℃で保存します。
Library Amplification 工程
- KAPA UDI Primer Mixes プレートを取り出し、 解凍してください。
- 280 xg, 30 秒間でプレートをスピンダウンしてください。
- 適切な(使用する)ウェルのホイルシールを剥がすか、穴を開けます。
注)ホイルシールに穴を開ける場合は、ウェルごとに新しいピペットチップを使用してクロスコンタミネーションを避けてください。使用したKAPA UDI Primer Mixes のウェル位置を記録し、ホイルシール等でシーリングして保管してください。 - 5 µLのKAPA UDI Primer Mixesを各サンプルに添加します。
- 25 µLのKAPA HiFi Hotstart ReadyMix を各サンプルに添加します。
- サンプル溶液を完全に混合し、クイックスピンダウンを行います。
- 以下のプログラムを使用して、サーマルサイクラーで反応させます。 蓋の温度を105℃に設定してください。
Step 温度(℃) 時間(min) サイクル 1 98 45 1 2 98 15 5 3 60 30 4 72 30 5 72 60 1 6 4 Hold ∞ lid temp 105℃
- インキュベーション後、直ちに次のステップに進んでください。