日本ジェネティクスのテクニカルノートとは?
発売したばかりの新製品の性能評価や、既存製品の最適な条件を追求するための条件検討をすることでお客様に心からご納得頂いた上で商品をお使い頂けるよう、様々な評価試験を行っています。
採用前の検討資料として、または採用後の最適条件検討資料としてご活用ください。
また、当データに関するご質問はお気軽にページ下部のフォームよりお問い合わせください。
|
テクニカルノート2017<07> |
目的
FastGene™ RNA Premium kitで推奨している「溶出後にDNaseⅠ処理するプロトコル」とオプションとして用意した「カラム上でのDNaseⅠ処理(オンカラムDNaseⅠ処理)」を比較して、その優位性を評価しました。
背景
一般的にシリカメンブレンカラム法でのRNA 精製ではDNaseⅠ処理が必須とはされていません。
しかしDNA 感受性が高いダウンストリームアプリケーションの場合、次のDNaseⅠ処理方法を選択することができます。
* 溶出後にDNaseⅠ処理:FastGene™ RNA Premium Kit スタンダードプロトコル
* カラム上でのDNaseⅠ処理(オンカラムDNaseⅠ処理):オプションプロトコル
<溶出後にDNaseⅠ処理>
FastGene™ RNA Premium Kitで推奨している方法です。
本方法の場合、RNAを通常の操作どおりにカラム精製を行っているため、塩類などの不純物は除去されます。このように高純度核酸をDNaseⅠ酵素反応に最も適した条件下で処理を行うため、安定して高いDNA 除去効率が期待できます。
<カラム上でのDNaseⅠ処理(オンカラムDNaseⅠ処理)>
操作の簡便性から実施されることが多い方法で、具体的には、RNA をカラムに結合後、カラム上でDNaseⅠ処理を行います。カラムによるRNA 精製では、RNA は塩濃度の高いバッファーを使用することにより、シリカメンブレンに結合させます。しかし、この高塩濃度のバッファーは、DNaseⅠ処理においては、酵素活性に悪影響を与えます。このため、オンカラムでDNaseⅠ処理をする際には、塩類の除去のために、いったんシリカメンブレンを適切な洗浄バッファーで洗浄する必要があります。塩類の除去が不十分な場合、DNaseⅠ活性が影響を受け、DNA の除去効率が下がります。一方で、塩濃度が低いバッファーでは、RNA の結合が弱くなってしまうため、RNA の収量に影響が出るリスクがあります。
通常、DNA 除去効率は次の通りに期待されます。
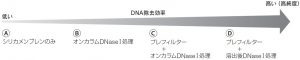
本技術資料では、これらのDNA除去効率が上記の通りの結果になることを示した一例をご紹介します。
実験条件
サンプル: Jurkat 細胞
5×105 cells /prep
n=3
評価ポイント:
① 収量
② RIN値
③ ゲノムDNA残留率
テスト条件:
| キット名 | DNaseⅠ処理 |
|---|---|
| FastGene™ Basic kit | A なし |
| B オンカラム | |
| FastGene™ Premium kit | C プレフィルター + オンカラム |
| D プレフィルター + 溶出後 | |
| Q社 kit | A なし |
| B オンカラム | |
| C プレフィルター + オンカラム |
結果
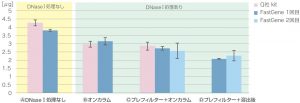
①収量
| キット名 | DNaseⅠ処理 | 1回目 | 2回目* | ||
|---|---|---|---|---|---|
| 収量 平均値[μg] | 収量 標準偏差 | 収量 平均値[μg] | 収量 標準偏差 | ||
| FastGene™ Basic kit |
A なし | 3.81 | 0.07 | ||
| B オンカラム | 3.15 | 0.22 | |||
| FastGene™ Premium kit |
C プレフィルター + オンカラム | 2.72 | 0.11 | 2.56 | 0.47 |
| D プレフィルター + 溶出後 | 2.07 | 0.02 | 2.27 | 0.32 | |
| Q社 kit | A なし | 4.26 | 0.18 | ||
| B オンカラム | 2.97 | 0.18 | |||
| C プレフィルター + オンカラム | 2.85 | 0.24 | |||
* 1回目のテストで、オンカラムDNaseⅠ処理の結果が考察していた結果よりもよかったため、2回目のテストを行い、再現性試験を行いました。
収量は、下記の順でした
ⒶDNaseⅠ処理なし > ⒷオンカラムDNaseⅠ処理 > Ⓒプレフィルター+オンカラムDNaseⅠ処理 > Ⓓプレフィルター+溶出後DNaseⅠ処理
この理由は、ゲノムDNAの残留量による影響が含まれたと考えられます。
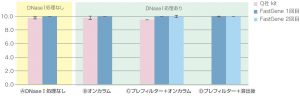
②RIN値
| キット名 | DNaseⅠ処理 | 1回目 | 2回目* | ||
|---|---|---|---|---|---|
| 収量 平均値[μg] | 収量 標準偏差 | 収量 平均値[μg] | 収量 標準偏差 | ||
| FastGene™ Basic kit |
A なし | 10 | 0 | ||
| B オンカラム | 10 | 0 | |||
| FastGene™ Premium kit |
C プレフィルター + オンカラム | 10 | 0 | 10 | 0.2 |
| D プレフィルター + 溶出後 | 10 | 0.1 | 10 | 0 | |
| Q社 kit | A なし | 9.8 | 0.2 | ||
| B オンカラム | 9.8 | 0.3 | |||
| C プレフィルター + オンカラム | 9.5 | 0 | |||
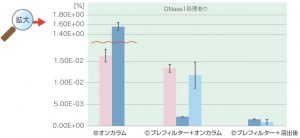
③ゲノムDNA残留率
吸光度(Abs.)とリアルタイムPCRの結果よりゲノムDNAの残留量を計算

| キット名 | DNaseⅠ処理 | 1回目 | 2回目 * | ||
|---|---|---|---|---|---|
| ゲノムDNA残留率 平均値 [%] |
ゲノムDNA残留率 標準偏差 |
ゲノムDNA残留率 平均値 [%] |
ゲノムDNA残留率 標準偏差 |
||
| FastGene™ Basic kit |
A なし | 1.16×10 | 1.65 | ||
| B オンカラム | 1.56 | 8.07×10-² | |||
| FastGene™ Premium kit |
C プレフィルター + オンカラム | 2.16×10-³ | 2.36×10-⁵ | 1.18×10-² | 3.00×10-³ |
| D プレフィルター + 溶出後 | 1.55×10-³ | 1.09×10-⁴ | 9.74×10-⁴ | 5.41×10-⁴ | |
| Q社 kit | A なし | 1.82×10 | 2.98 | ||
| B オンカラム | 1.63×10-² | 1.47×10-³ | |||
| C プレフィルター + オンカラム | 1.33×10-² | 9.13×10-⁴ | |||

まとめ

豊富なテクニカルノート
FastGene™ RNA Basic Kit の性能を評価したテクニカルノートは他にも多数ございます。
製品詳細ページよりご覧ください。






















■収量:
ⒶDNaseⅠ処理なし>ⒷオンカラムDNaseⅠ処理>Ⓒプレフィルター+オンカラムDNaseⅠ処理>Ⓓプレフィルター+溶出後DNaseⅠ処理
■RIN値:
どの条件でも同様の傾向
■ゲノムDNA除去効率:
Ⓓプレフィルター+溶出後DNaseⅠ処理>Ⓒプレフィルター+オンカラムDNaseⅠ処理>ⒷオンカラムDNaseⅠ処理>ⒶDNaseⅠ処理なし
これらの結果により、本条件においては、FastGene™ RNA Premium Kitで推奨している「溶出後DNaseⅠ処理」がゲノムDNA除去に効果的であることが示されました。