日本ジェネティクスのアプリケーションノートとは?
- 当社製品を実際にご使用頂いた、正真正銘、日本国内の研究者様による評価データ
- 製品をご検討中の方はもちろん、すでにお使いのお客様におかれましても、類似の研究をされている他の研究者の方の事例集としてご活用頂けます
アプリケーション検索専用ページはこちら
メーカー名:日本ジェネティクス株式会社
下記のデータは、東京理科大学基礎工学部生物工学科 ゲノム生物学研究室(村上研究室)
柏葉 脩一郎様のご厚意により掲載させていただきました。
概要
近年、主要な生物種において、全遺伝情報(ゲノム)の解析が完了し、すべての遺伝子の塩基配列が明らかになりました。
当研究室では、このゲノム情報の活用によりヒトやマウスにおける遺伝子発現のメカニズムの解明や疾患を治療するための基盤となる研究を行っています。マイクロアレイや RNA-seq により組織や細胞内における遺伝子発現パターンを解析する等、基礎と応用の両面から研究を進めています。RNAは不安定なため、実験に用いる際は特に安定的に精製できることが重要になってきます。
今回は、RNAの精製にFastGene™ RNA Premium Kitが従来のキット(Q社製品)と比較して、同等に使用できるか検討しました。
準備
●RNA精製条件
サンプルの種類 :マウス乳癌由来FM3A細胞
サンプル量 :4×106 cells
DNaseⅠ処理 :FastGene™は溶出後にDNaseⅠ処理、Q社はカラム上でのDNaseⅠ処理
RNA溶出バッファー量 :30μL
●逆転写条件
インプットRNA量 :1μg(1反応20μLあたり)
逆転写酵素 :ReverTra Ace(TOYOBO社)
反応組成:
+RT -RT
total RNA 5 μg 5 μg
D.W. 12-X μL 13-X μL
oligo dT20 Primer(10μM) 1 μL 1 μL
5×Buffer 4 μL 4 μL
10 mM dNTPs 2 μL 2 μL
ReverTra Ace(100 U/μL) 1 μL 0 μL
(Total volume 20 μL 20 μL )
反応プログラム:
アニーリング 30℃・10min
↓
酵素反応 42℃・30min
↓
変性 99℃・5min
●PCR条件
インプットcDNA量 :1 μL(逆転写条件の反応液)
PCR試薬 :KOD – Plus- Neo (TOYOBO 社)
PCR装置 :T100(Bio-Rad社)
● 電気泳動条件
1 %TAEアガロースゲル, 100 V, 30 min
核酸染色試薬 :エチジウムブロマイド(後染め)
イルミネーター :UV(ATTO社AE-6932GXESプリントグラフ)
RNAの泳動時には、ホルムアミドを含むローディングバッファーを使用
ワークフロー
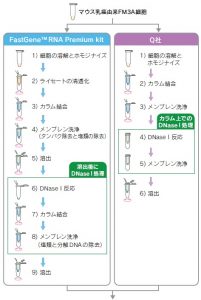
濃度測定(吸光度)
↓
逆転写
↓
PCR増幅
↓
電気泳動

結果
<NanoDropによる収量と純度>
| 260/280 | 260/230 | 収量(µg) | |
|---|---|---|---|
| FG | 2.07 | 2.23 | 33.0 |
| Q | 2.09 | 1.65 | 34.2 |
FG: FastGene™ RNA Premium Kit
Q: Q 社 RNA 抽出キット (DNase I 処理有り)
収量、純度ともに Q社キットを用いた場合と同様だった。
<電気泳動結果A(精製RNA)>
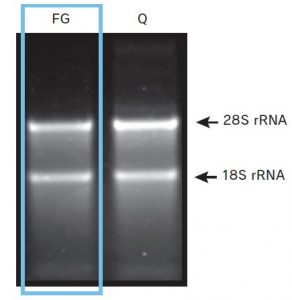
抽出したRNA 500 ng を 1% 非変性アガロースゲル
で解析した。
FastGene™ RNA Premium Kit、及び Q 社 RNA抽出キットのいずれを用いて得たRNA 共に、28SrRNA、18S rRNA の明瞭なバンドが確認できた。
<電気泳動結果B(cDNAを用いた遺伝子Aの増幅)>
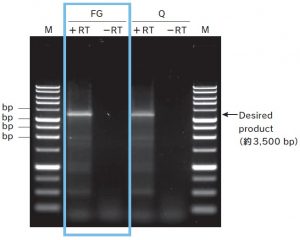
抽出したRNA を用いて、oligo dT20 プライマーと逆転写酵素ReverTra Ace(TOYOBO 社)によりcDNAを合成した。
得られた cDNA から、PCR 酵素KOD -Plus- Neo( TOYOBO 社)を用いて遺伝子A(約3,500 bp)の全長を増幅し、pUC19ベクターへのクローニングを試みた。
PCR 産物 5μLを1%アガロースゲルを用いて泳動したところ、FastGene™ RNA Premium Kit、Q社RNA抽出キットいずれを用いて得たRNAからも、目的の位置にバンドが確認された。
また、このDNA断片をpUC19 ベクターにクローニングして塩基配列を解析したところ、遺伝子A の挿入が確認された。

評価のため Q 社のキットと比較したところ、同等の収量と純度で トータル RNA を精製することができました。
得られた RNA から cDNA を合成し、PCR により遺伝子 A の増幅を試みたところ、目的の位置にバンドが検出されました。
この断片を精製し、制限酵素を用いてベクターに挿入したところ、問題なく遺伝子 A を単離することができました。
また、当研究室では他にも qRT-PCR で Q 社キットを用いた場合と同等の結果が得られております。
本キットは高い収量で純度の高いRNAを安定的に精製できることに加え、比較的安価であることから、RNA 精製キットに価格と質を求める方には、強くお勧め致します。
- こちらのアプリケーションノートのPDFダウンロード : こちら
- アプリケーションノート検索ページ(型番・キーワード・アプリケーションから検索可能)



















しっかりとDNaseⅠ処理して、gDNA除去をされたいお客様には、「溶出後にDNaseⅠ処理」をオススメします!
gDNA除去効率
カラム上でのDNaseⅠ処理 < 溶出後にDNaseⅠ処理
詳しくはこちらの資料をご覧ください!
テクニカルデータシート2017<02>
「FastGene™ RNA Basic / Premium kit の評価試験」