日本ジェネティクスのアプリケーションノートとは?
- 当社製品を実際にご使用頂いた、正真正銘、日本国内の研究者様による評価データ
- 製品をご検討中の方はもちろん、すでにお使いのお客様におかれましても、類似の研究をされている他の研究者の方の事例集としてご活用頂けます
アプリケーション検索専用ページはこちら
| アプリケーションノート 2020<01> 製品名:FastGene™ miRNA Enhancer kit(Cat.No. FG-RNAE-S, FG-RNAE-25) FastGene™ RNA Premium kit(Cat.No. FG-81006, FG-81050, FG-81250) メーカー名:日本ジェネティクス株式会社 |
下記のデータは、社会医療法人大雄会医科学研究所 菊池 有純様のご厚意により掲載させて頂きました。
概 要
臨床検査室のサンプルは、組織、血液、尿、髄液などの臨床検体が対象であり、PCRにおける反応阻害物質を除去し、解析に必要な十分量を確保する必要があります。遺伝子検査において試料から解析対象となる核酸の抽出は検査の精度を維持する上で極めて重要です。とりわけ、様々な状態が想定される臨床検体において、安定的に試料調整が可能な抽出方法の構築は必須です。
本アプリケーションノートでは、FastGene™ miRNA Enhancer kitとFastGene™ RNA Premium kitまたは他社RNA抽出キットを組み合わせて臨床検体を含む様々なサンプルからmiRNAを抽出し、cDNA合成後リアルタイムPCRによりCp値を評価した一例を報告します。
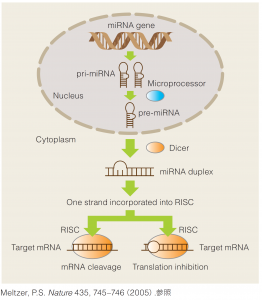
| ● miRNAとは • 約30%のヒト遺伝子がmiRNAによる調節を受けていると予想されている。 • ゲノムから転写後、precursor miRNAがいくつかの酵素類の作用の後にmature miRNAとなる。 • mature miRNAは21 ~ 23nt の1本鎖RNAとなりmRNAと相互作用する。 • miRBase Release22(2018)によると38,589が登録されている。 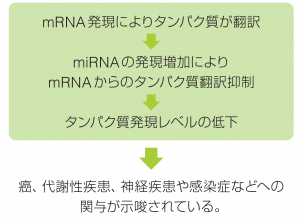 |
 |
実験条件
|
対象サンプルと前処理方法
• Cell line (K562) → 細胞数105個に調整したペレットを使用(n=3) • human white blood cell(臨床検体) → EDTA・2Na抗凝固剤入り採血管を用い、健常者3 名より採血した全血500 μLの溶血剤処理後の白血球のペレットを使用(n=3) • Formalin-fixed paraffin-embedded(FFPE) tissue sample(臨床検体) → 大腸癌患者5例から採取した大腸組織のFFPE サンプル(詳細は*) • Bovine muscle → 組織と等量のPBS(-)を用い、ホモジナイズした溶液10 μL(n=3) |
*FFPEの前処理方法の詳細
1) 厚さ5 μmのFFPE標本から試料を採取する 2) 800 μLキシレンを加える 3) 室温で5 min インキュベート 4) 400 μL無水エタノールを加える 5) 2 min 遠心分離し、上清を廃棄 6) 1000 μL無水エタノールを加える 7) 2 min 遠心分離し、上清を廃棄 8) 56 ℃で20 min インキュベート 9) 100 μLの溶解バッファー (10 nmol/L Tris-HCl, 0.1 mmol/L EDTA, 5 g/L SDS) を加える 10) 40 μLのproteinase Kを加える 11) 56 ℃で30 min インキュベート 12) 85 ℃で30 min インキュベート 13) 溶解バッファーを加え、全量を150 μLとする
|
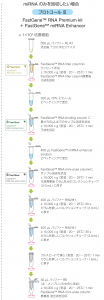
検討方法ワークフロー
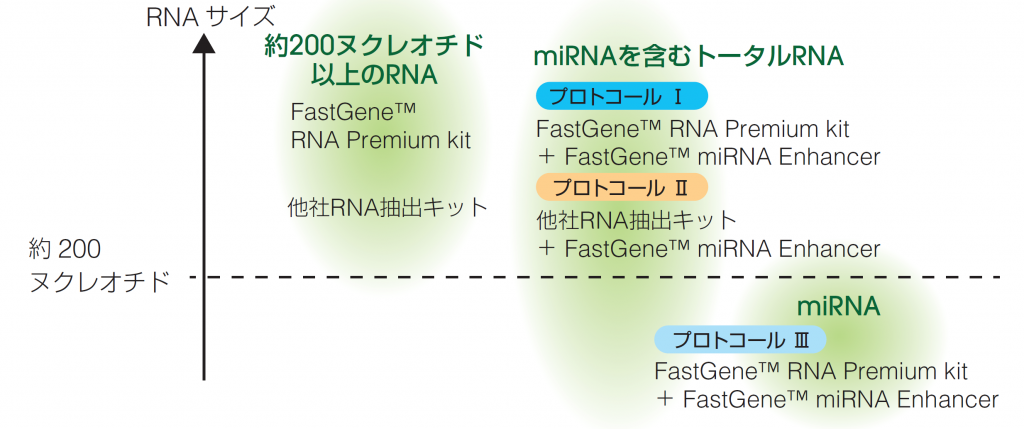
● キットとプロトコールの選択ガイド
FastGene™ miRNA Enhancerは、FastGene™ RNA Basic kit、FastGene™ RNA Premium kit や他社RNA抽出キットと併用していただくことで、抽出が困難な低分子RNA(miRNA)を回収することが可能になります。
本アプリケーションノートでは、FastGene™ miRNA EnhancerとFastGene™ RNA Premium kitまたは他社RNA抽出を組み合わせた右記のプロトコールを使用しました。さらに抽出したmiRNAをcDNA合成後、リアルタイムPCRを行うことによりCp値の評価を行いました。
本アプリノートで使用しているkit の選択方法

|
 |
| miR-21解析に用いたステムループRTプライマーとcDNA合成(Cell line・human white blood cell・FFPE検体で使用) | |
| ● Stem- Loop RT-primer sequences 5’→3’ miR-21 GTCAGAGGAGGTGCAGGGTCCGAGGTATTCGCACCTCCTCTGACTCAACA |
● Reaction condition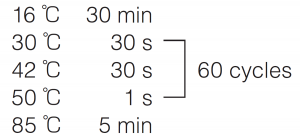 |
|
● Reverse Transcript → cDNA |
|
| miR-21解析に用いたリアルタイムPCR時のプライマー配列、プローブ、反応条件および反応液 |
|
| ● Primer sequences(5’→3’) and Probe miR-21 Forward primer GATCGGTAGCTTATCAGACTGATG Reverse primer GTGCAGGGTCCGGGTAAT Universal ProbeLibrary Probe(Roche) #82 |
● Reaction conditions |
| ● Reaction mixtures 2.5 μL of cDNA solution 5 μL of Essential Probe Master(Roche) 0.4 μM of each primer 0.4 μM of UPL probe (Roche) (in a final volume of 10 μL) 反応はLightCycler 96(Roche)で実施した。2 重測定の平均値を測定値とした。 |
|
| bta-miR-23a 解析に用いたステムループRTプライマーとcDNA合成(Bovine muscleで使用) |
|
| ● Stem- Loop RT-primer sequences 5’→3’ bta-miR-23a CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTGGAAATC * *Guan L et. al.: Sci Rep, 7: 43716, 2017 |
● Reaction condition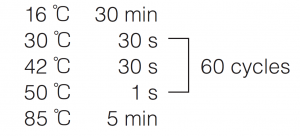 |
| ● Reverse Transcript → cDNA Transcriptor RT Reaction Buffer(5×)(Roche) 2 μL Stem-Loop RT-primer(10 μM) 0.2 μL Transcriptor Reverse Transcriptase(20 U/μL)(Roche) 0.25 μL Protector Rnase Inhibitor(40 U/μL)(Roche) 0.2 5μL Deoxynucleotide Mix(10 mM)(Roche) 1 μL RNA solution 2.5 μL Water 3.8 μL |
|
| bta-miR-23a 解析に用いたプライマー配列、反応条件および反応液 |
|
| ● 1 Primer sequences(5’→3’) * bta-miR-23a Forward primer CCGAGTCAGATCACATTGCCAGG Reverse primer CTCAACTGGTGTCGTGGAGTCG *Guan L et. al.: Sci Rep, 7: 43716, 2017 |
● Reaction condition |
| ● Reaction mixtures 2.5 μL of cDNA solution 5 μL of KAPA SYBR Fast qPCR (KAPA) 0.4 μM of each primer (in a final volume of 10 μL) 反応はLightCycler 96(Roche)で実施した。2 重測定の平均値を測定値とした。 |
|
結果
| ● ⅠⅡのプロトコルを使用:FastGene™ miRNA Enhancerを使用・未使用の際のリアルタイムPCRによるCp値の評価 | |
 |
|
| どのキットにおいてもFastGene™ miRNA Enhancerを加えることによりmiRNAの収量が向上した。
|
|
|
●ⅠⅡのプロトコルを使用: FastGene™ miRNA Enhancer |
●ⅠⅡのプロトコルを使用: FastGene™ miRNA Enhancer を使用した際のリアルタイムPCRによるCp値の評価 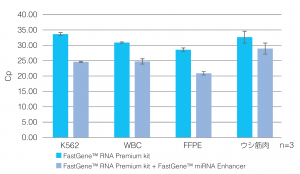 |
| どのキットにおいてもⅠ、Ⅱのプロトコルを使用した際のCp値は同程度だった。 | どのサンプルにおいてもⅢのプロトコルを使用することによりmiRNAの収量が向上した。 |
| ● ⅠとⅢのプロトコルを使用: ΔCpの評価 |
|
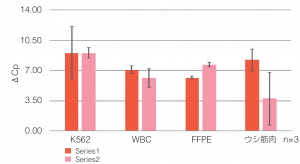 |
Ⅰのプロトコルを使用した場合でも、 Ⅲのプロトコルを使用した場合でも、 miRNAの抽出量は同程度だった。 |
ΔCpの算出方法 ΔCp=(FastGene™ miRNA Enhancer未使用の際のCp値) -( FastGene™ miRNA Enhancer使用の際のCp値) |
|
FastGene™ miRNA Enhancerを加えることにより、どちらのキットを用いてもmiRNAの収量が向上しました。
また、カラムを通す回数が異なっても、miRNAの抽出量は同程度であることがわかりました。

- こちらのアプリケーションノートのPDFダウンロード : こちら
- 製品情報詳細ページ: FastGene™ miRNA Enhancer kit
: FastGene™ RNA Premium kit - アプリケーションノート検索ページ(型番・キーワード・アプリケーションから検索可能)




















FastGene™シリーズのRNA抽出試薬は純度・収量が優れていることから、この試薬と組み合わせることで他社のmiRNA抽出専用試薬と同等以上の効果が期待できると思います。