日本ジェネティクスのテクニカルノートとは?
発売したばかりの新製品の性能評価や、既存製品の最適な条件を追求するための条件検討をすることでお客様に心からご納得頂いた上で商品をお使い頂けるよう、様々な評価試験を行っています。
採用前の検討資料として、または採用後の最適条件検討資料としてご活用ください。
また、当データに関するご質問はお気軽にページ下部のフォームよりお問い合わせください。
目的
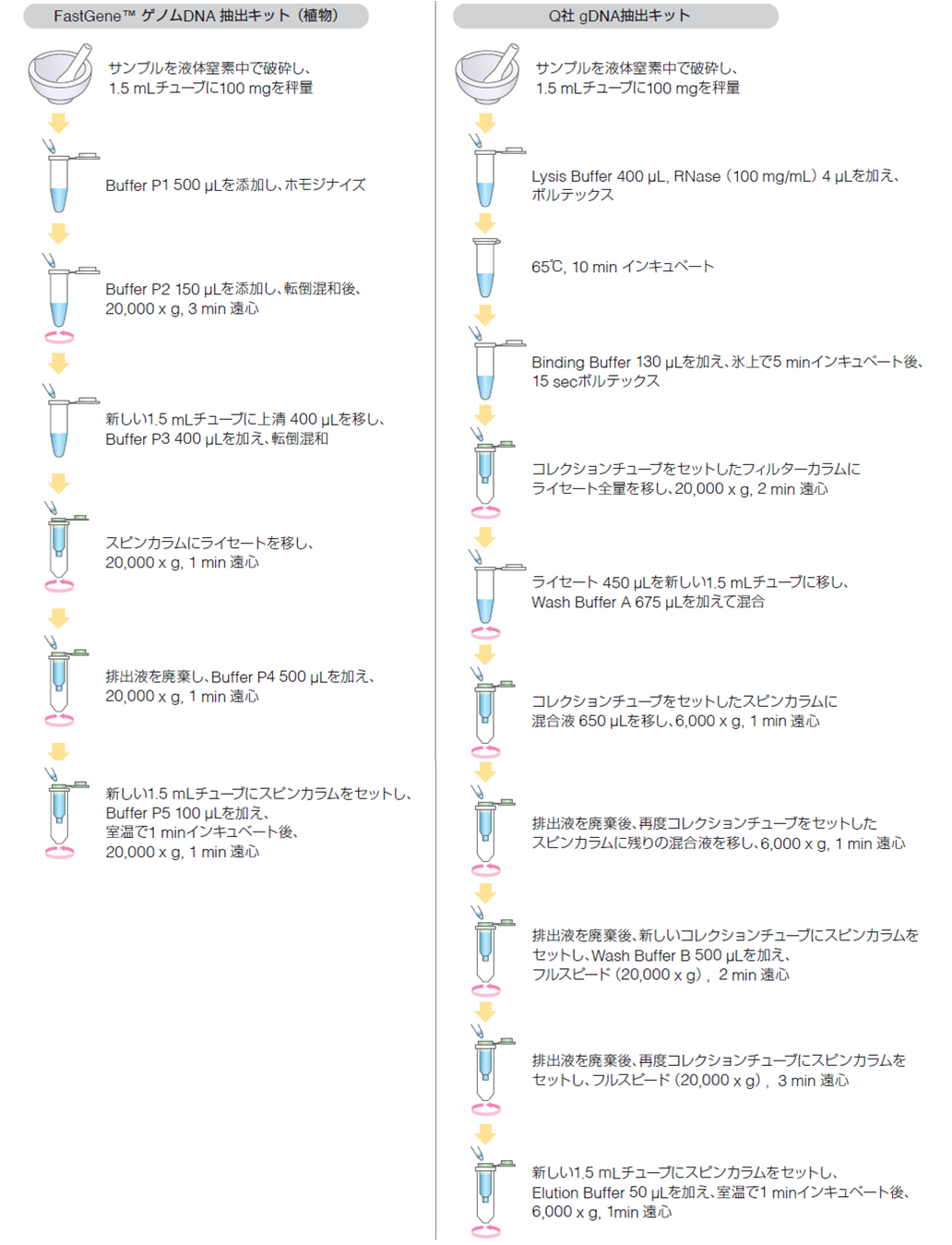
レタスの葉とホウレンソウの葉からゲノムDNA(以下gDNA)をそれぞれ抽出し、FastGene™ ゲノムDNA 抽出キット(植物)の性能を評価する。
実験概要
一般的なDNA抽出キットに含まれるスピンカラムには、シリカメンブレンが使用されているが、スピンカラムのフィルターに溶液が残りやすく、デッドボリュームが大きいという課題がある。
FastGene™ ゲノムDNA抽出キット(植物)のスピンカラムには、次世代の分離媒体として注目されているシリカモノリスが使用されている。
シリカモノリスは、ケイ酸エチルから合成された一体型の超高純度シリカゲルで、均一な細孔が無数に開いている網目状構造をもっている。この構造により、大きな通液空間と広い表面積を保てるため、シリカメンブレンよりも圧倒的に通液性が良く、デッドボリュームも小さいため、より効率的に核酸精製が可能である。
本テクニカルノートでは、レタスの葉とホウレンソウの葉を用いてそれぞれgDNAの抽出を行い、スピンカラムの材質がシリカメンブレンである他社gDNA抽出キットの結果と比較することで、本製品の性能評価を行った。
評価方法
●サンプル
レタスの葉、ホウレンソウの葉(各100 mg, n=3)
●使用キット
FastGene™ ゲノムDNA 抽出キット(植物)
Q社 gDNA抽出キット
●評価項目
各キットの取扱説明書に従って抽出したgDNAを、以下の項目において比較・検討した。
- 工程数、操作時間
- 収量
- 純度
- アガロースゲル電気泳動
- PCRによる目的のアンプリコンサイズの確認
植物サンプル(~200 mg)からのゲノムDNA抽出キットです。
洗浄バッファー(Buffer P4)にはエタノールが含まれているため、別途エタノールを添加する必要がありません。
結果
- 工程数、操作時間
キット 工程数 操作時間(n=3 抽出時) FastGene™ ゲノムDNA抽出キット(植物) 7 30 min 30 sec Q社 gDNA抽出キット 11 1 H 11 min ※サンプルの破砕にかかる時間を含まない。
Q社 gDNA抽出キットでは、RNase処理が必須であるため、工程数が多い。
しかし、RNase処理にかかる時間を考慮しても、FastGene™ ゲノムDNA 抽出キット(植物)の方が、溶解工程と洗浄工程における操作が少なく、Q社 gDNA抽出キットよりも短時間でgDNAを抽出することができた。 - 収量
Qubitによる測定(n=3の平均を算出)キット レタス ホウレンソウ Conc.
(ng/μL)Elution
(μL)Yield
(ng)Conc.
(ng/μL)Elution
(μL)Yield
(ng)FastGene™ ゲノムDNA 抽出キット(植物) 26.2 100 2620 9.8 100 980 Q社 gDNA抽出キット 13.0 100 1300 11.9 100 1190 装置:Qubit 4 Fluorometer(Thermo Fisher Scientific, Cat.No. Q33238)
キット:Qubit dsDNA BR Assay Kits (Thermo Fisher Scientific,Cat.No.Q32850)Q社 gDNA抽出キットと同等以上のgDNAを回収することができた。
- 純度
NanoDrop OneCによる測定(n=3の平均を算出)キット レタス ホウレンソウ A260/A280 A260/A230 A260/A230 A260/A230 FastGene™ ゲノムDNA 抽出キット(植物) 1.97 2.17 2.34 1.21 Q社 gDNA抽出キット 1.73 1.51 1.50 1.48 装置:NanoDrop OneC(Thermo Fisher Scientific, Cat.No. ND-ONEC-W)
FastGene™ ゲノムDNA 抽出キット(植物)は、A260/280の値が高く、RNAが残存している可能性がある。
Q社 gDNA抽出キットでは、RNase処理が必須のプロトコルになっているため、A260/280の値に差が生じたと考えられる。 - アガロースゲル電気泳動
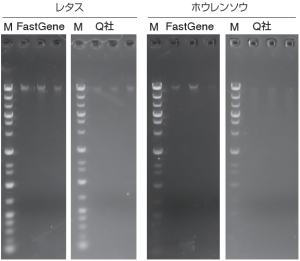
●電気泳動条件
ゲル:1.0% アガロースゲル
バッファー:1 x TAE
泳動条件:100 V, 60 min
泳動槽:SafeBlue Illuminator/ Electrophoresis System(Major Science, Cat.No. MBE-150-PLUS)
核酸染色試薬:Midori Green Xtra(FastGene, NE-MG10),先染め染色法
DNAマーカー:Gene Ladder wide 1(0.1 – 20 kbp)(ニッポンジーン, Cat.No. 313-06961)
撮影装置:FAS-Digi Compact(日本ジェネティクス株式会社, Cat.No. GP-08LED)
撮影条件:F=5.6, Exposure 1.6 sec, ISO=125gDNAのバンドを確認することができた。
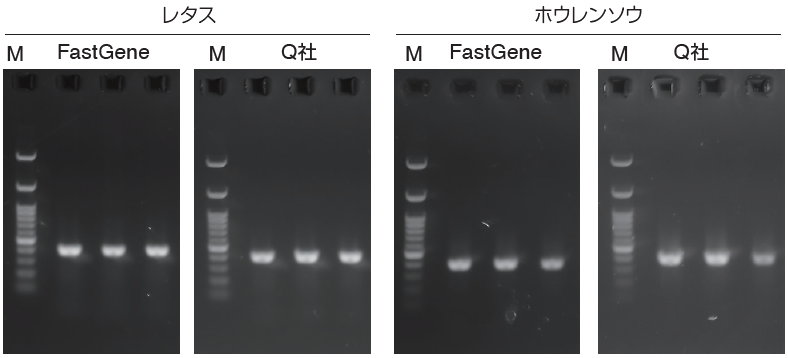
- PCRによる目的のアンプリコンサイズの確認
KAPATaq Extra Hot Start ReadyMix with dye(KAPA BIOSYSTEMS, Cat.No. KK3606)を用いて、アンプリコンサイズ約350 ~ 400 bpのPCRを行った。
●電気泳動条件
ゲル:1.5% アガロースゲル
バッファー:1 x TAE
泳動条件:100 V, 25 min
泳動槽:SafeBlue Illuminator/ Electrophoresis System(Major Science, Cat.No. MBE-150-PLUS)
核酸染色試薬:Midori Green Xtra(FastGene, NE-MG10), 先染め染色法
DNAマーカー:100 bp DNA Ladder PLUS(FastGene, Cat.No. NE-MWD100P)
撮影装置:FAS-Digi Compact(日本ジェネティクス株式会社, Cat.No. GP-08LED)
撮影条件:F=5.6, Exposure 1/3 sec, ISO=200すべての抽出gDNAで目的サイズの増幅が確認され、PCR阻害等の問題は無かった。
また、スピンカラムの液切れが良いため、スピンカラムの乾燥工程である空遠心を行わなくても、不純物やバッファーを効率よく除去することができる製品である。
しかし、使用するサンプルや目的のアプリケーションによっては、別途RNase 処理を行う必要があると考えられる。
補足
PCRによる目的のアンプリコンサイズの確認におけるPCR条件
●反応液組成
| Component | Volume |
|---|---|
| 2X KAPA Taq Extra HotStart Ready Mix with dye | 5 μL |
| 25 μM Forward Primer | 0.2 μL |
| 25 μM Reverse Primer | 0.2 μL |
| Template DNA | 2 μL |
| PCR-grade water | 2.6 μL |
| Total | 10 μL |
●反応条件
| Step | Temperature | Time | Cycle |
|---|---|---|---|
| Initial Denaturation | 95℃ | 3 min | – |
| Denaturation | 95℃ | 30 sec | 35 Cycles |
| Annealing | 60℃ | 30 sec | |
| Extension | 72℃ | 1 min | |
| Final Extension | 72℃ | 1 min | – |
| Hold | 4℃ | ∞ | – |
●プライマー
植物異物同定用プライマーセット(FASMAC #F111-1K)
アンプリコンサイズ:350 ~ 400 bp