日本ジェネティクスのアプリケーションノートとは?
- 当社製品を実際にご使用頂いた、正真正銘、日本国内の研究者様による評価データ
- 製品をご検討中の方はもちろん、すでにお使いのお客様におかれましても、類似の研究をされている他の研究者の方の事例集としてご活用頂けます
アプリケーション検索専用ページはこちら
| アプリケーションノート 2018<11> 製品/メーカー名:KAPATaq EXtra PCR Kit(Cat No. KK3009)/KAPA BIOSYSTEMS ミドリグリーンアドバンス(Cat No. NE-MG04)/日本ジェネティクス株式会社 FAS-Nano(Cat No. FAS-Nano)/日本ジェネティクス株式会社 |
下記データは、東京医科大学 生化学分野 高野 直治 様、森谷 昇太 様のご厚意により掲載させていただきました。
はじめに
本アプリケーションノートでは「お酒に強い」「弱い」を決定するアルデヒド脱水素酵素(ALDH2)遺伝子のSNP(※1)を題材としています。
| ※1 : SNPとは? ヒトとヒトのDNAの配列は、99.9%が同じであり、0.1%の遺伝情報の違いが、個人間の顔や体型、体質、性格の違いなど、ヒトの多様性を生み出していると考えられています。 一塩基多型(SNP) は遺伝子の塩基配列が1カ所だけ異なっている状態を指し、SNPのタイプにより、酵素などの生体内タンパク質の働きが微妙に変化することが知られています。 SNPにより病気への罹り易さや、医薬品への反応に差が出ることが知られており、医療分野ではSNPを元に患者個人に最適な治療方法を計画する「オーダーメイド医療」の開発が期待されています。 |
実験
今回の実験では、頬粘膜細胞からゲノムDNA を抽出し、PCR 法によりアルコール代謝に関わる、ALDH2 遺伝子を増幅させます。
その後、増幅断片を制限酵素で処理し、アガロース電気泳動でALDH2の遺伝型を判定することで、お酒の強さを確認致します。
その後、増幅断片を制限酵素で処理し、アガロース電気泳動でALDH2の遺伝型を判定することで、お酒の強さを確認致します。
参考文献:
Helminen A, Väkeväinen S, Salaspuro M.
ALDH2 genotype has noeffect on salivary acetaldehyde without the presence of ethanol in thesystemic circulation.
PLoS One. 2013;8:e74418.
(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3772811/)
実験方法
●サンプル
インフォームド・コンセントが得られたヒトから口腔粘膜を生理食塩水にて回収し、InstaGene(BIO-RAD)にてゲノムDNAを抽出した
PCR反応
| ● PCR 反応組成液 KAPATaq EXtra DNAポリメラーゼ(5U/μL) 0.2 μL 5×KAPATaq EXtra バッファー(Mg2+ free) 8 μL 25mM MgCl2 2.8 μL dNTP Mix(10mM each) 1 μL PrimerF(10μM) 2 μL PrimerR(10μM) 2 μL Template DNA 20 μL PCR grade Water 4 μL total 40 μL |
● サーマルサイクラー条件
|
| ● プライマー配列 Forwardプライマー :TCAAATTACAGGGTCAACTGCT Reverseプライマー :GGCTGGGTCTTTACCCTCTC |
参考文献: Helminen A, Väkeväinen S, Salaspuro M. ALDH2 genotype has noeffect on salivary acetaldehyde without the presence of ethanol in the systemic circulation. PLoS One. 2013;8:e74418. |
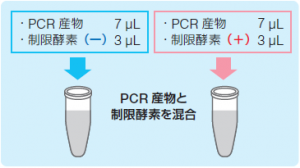
制限酵素処理
| 制限酵素(-) 超純水 2.8 μL 10xCutSmart Buffer 1.6 μL 1.6mM S-adenosyl- methionine※ 0.4 μL total 4.8 μL |
制限酵素(+) 超純水 2 μL 10xCutSmart Buffer 1.6 μL 1.6mM S-adenosyl- methionine※ 0.4 μL Acu I 0.8 μL total 4.8 μL |
 |
|
| ※ 最終濃度40μM Acu I :NEB社 10xCutSmart BufferとS-adenosyl-methionineはAcu I に付属 S-adenosyl-methionineは1.6mMをストック溶液とした |
|||
電気泳動
| アガロース:アガロース(日本ジェネティクス:Cat No.NE-AG01) 核酸染色試薬:ミドリグリーンアドバンス (日本ジェネティクス:Cat No.NE-MG04) 電気泳動条件:100V ゲル全体の1/2まで進んだら泳動を停止 する。 バッファー:TBE 電気泳動装置: Mupid-2plus |
 |
① ラダーマーカー ( CatNo : MWD100) ② 制限酵素処理(-) ③ 制限酵素処理(+) |
| Loading Dyeはニッポンジーン:313-90111(SDS含有, BPB, XC)SDS含有のほうが綺麗な実験結果が得られています。 特に、この実験は泳動サンプルにTaq, 制限酵素などの不純物が多く入りますので、SDS入りを使わないとバンドパターンが乱れてしまう可能性があります。 |
||
実験結果
ラダーマーカー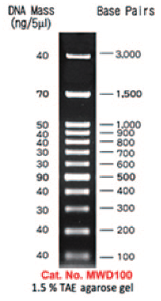 |
野生型ホモ ヘテロ 変異型ホモ (酒に弱い) (酒に強い) (酒が飲めない) AcuI 制限酵素処理 - + - + - + 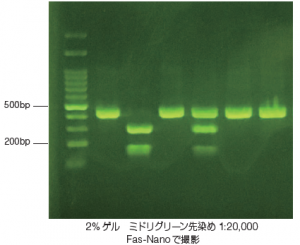
|
3 種の遺伝子型の電気泳動結果のパターンを掲載する。
AcuIによる制限消化前は、いずれも430bpのPCR増幅産物が確認された。
制限酵素 AcuI 処理により、野生型ホモでは296bp と 134bpの断片が生じた。
一方、変異型ホモ(ALDH2-1の114塩基目のGがAに置換)では、AcuI の認識部位が変異を起こしているため、430bpのまま切断されなかった。
ヘテロでは、430bp 、296bp、134bp両方のバンドが確認された。
※結果の電気泳動写真は、全てのバンドパターンを確認するためクローニングを行ったポジティブコントロールにて電気泳動を行っています。

- こちらのアプリケーションノートのPDFダウンロード : こちら
- 製品情報詳細ページ: KAPATaq EXtra PCR Kit
ミドリグリーンアドバンス
FAS-Nano - アプリケーションノート検索ページ(型番・キーワード・アプリケーションから検索可能)




















学生実習(学生120名)を行うにあたり、経費削減の観点からコストパフォーマンスに優れたPCRキットを探していました。
そこで、KAPATaq EXtra PCRキットを試してみたところ、良好な実験結果が得られました。(なお、近年ではdNTPやバッファーなどがすでに混ざってセットになったタイプも市販されていますが、本品は別々になっていることから学生実習でそれぞれの試薬が持つ意味を教育する観点からも選択しました。)
KAPATaq EXtra PCRキットは、非常にコストパフォーマンスに優れていると思います。
Fas-Nanoを使うことにより、エチブロフリーで安全な実習を行えたこともよかったです。(森谷 様)