日本ジェネティクスのアプリケーションノートとは?
- 当社製品を実際にご使用頂いた、正真正銘、日本国内の研究者様による評価データ
- 製品をご検討中の方はもちろん、すでにお使いのお客様におかれましても、類似の研究をされている他の研究者の方の事例集としてご活用頂けます
アプリケーションノート検索専用ページはこちら
メーカー名:日本ジェネティクス株式会社
下記のデータは、東京大学大学院理学系研究科生物科学専攻 加用大地 様、神田真司 様のご厚意により掲載させていただきました。
背景
RNAの抽出は、定量的PCRなど、さまざまな場面で行いますが、近年はシリカカラムをベースにしたものが増えています。しかしながら、DNAとRNAは似た性質を持つため、DNAの分離は困難であり、特に微量の発現を定量する際、DNAの混入が大きな問題になることがあります。そういった理由から、従来よりDNaseⅠによる除去や、ゲノムDNA除去カラムの利用などの対策が取られてきました。
今回、市販のRNA抽出キットのRNA収量およびDNA混入量について検討した結果、FastGene™ RNA Basic Kit は、特別な操作を行わずともDNAの混入が極めて少ないことが分かりました。
そこで、その後のリアルタイム定量PCRにおいて、「逆転写を行わないコントロール」実験を並行して実施すれば、本キット単体でも充分な精度の定量RT-PCRが行えると考えました。
(「逆転写を行わないコントロール」の条件で増幅が認められた場合、RNAサンプル中にゲノムDNAが残留している可能性が示唆される。)
以上について、他社製品との比較も含めて行った実験結果をご紹介します。
方法
RNA抽出
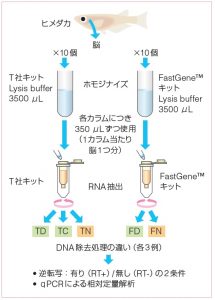
1. サンプル調製
ヒメダカの脳を10 個ずつ摘出し、それぞれのキットのLysisバッファー3500 μLに加え、ハンディマイクロホモジナイザー(physcotron NS-310E マイクロテック・ニチオン)を用いてホモジナイズした。
RNA抽出処理を行うまでディープフリーザーに保管した。
2. RNA抽出
使用キット:(1)T 社RNA抽出キット (2)FastGene™ RNA Basic Kit Lysisバッファー中でホモジナイズしたサンプルを350 μLずつ分注し(1カラム当たり脳1つ分)、各条件のもとでRNA抽出した。
3. DNA除去処理
以下の5つの条件で実施した。なお、各条件につき3カラム使用した。
| T 社キット | FastGene™キット | ||
|---|---|---|---|
| DNA除去処理あり | DNase処理*1 | TD | FD |
| カラム除去*2 | TC | ー | |
| DNA除去処理なし*3 | TN | FN |
*1: DNase 処理を実施
RNA結合カラム処理の後、メンブレン洗浄に移る前に、
T 社DNaseを用い、メンブレン上で室温15分間処理した。
*2: ゲノムDNA除去カラム処理を実施。
T 社キットの推奨プロトコール通り実施した。
*3: DNA除去処理は未実施。
上記*1、*2、いずれの工程もスキップした。
4. 溶出
それぞれのキット付属の溶出バッファー50 μLで溶出した。
抽出したRNAサンプルの評価
以下のように実施した。
1.Qubitによる測定
Qubitを使用してRNAの収量を測定した。
また、DNAの収量も測定することで、残存するゲノムの量についても調べた。
2.qPCRによる相対定量
RNA40 ngを含むサンプルに対し、TaKaRa社、PrimeScript RT Master Mixを用いて5 μLの反応系で逆転写を行った。
完成したcDNAをテンプレートにribosomal protein 13 (rps13) 遺伝子の相対発現量を定量した。
逆転写有り(RT+)に加え、逆転写無し(RT-)もqPCRし、ゲノムのコンタミネーションが定量にどの程度影響を与えるかについても検証した。
結果
収量(Qubit)
RNA収量
| DNA除去処理あり | DNA除去処理なし | ||||
| RNA (ng/μL)Qubit | TD | FD | TC | TN | FN |
| カラム1 | 67.4 | 20.4 | 40.2 | 54.8 | 41.6 |
| カラム2 | 70.6 | 35.0 | 43.4 | 55.6 | 39.8 |
| カラム3 | 59.0 | 17.3 | 41.8 | 53.8 | 55.8 |
DNA残留量
| DNA除去処理あり | DNA除去処理なし | ||||
| DNA (ng/μL) | TD | FD | TC | TN | FN |
| カラム1 | 1.100 | 0.450 | 0.370 | 17.0 | 0.614 |
| カラム2 | 0.848 | 0.480 | 0.258 | 14.4 | 0.500 |
| カラム3 | 1.050 | 0.466 | 0.374 | 17.1 | 0.552 |
■FastGene™ RNA Basic kit : FD、FN
qPCR
Cp値(rps13)
| DNA除去処理あり | DNA除去処理なし | |||||
| RT+ | TD | FD | TC | TN | FN | NTC |
| カラム1 | 18.23 | 17.79 | 18.33 | 17.18 | 17.87 | |
| カラム2 | 17.80 | 17.69 | 18.34 | 17.34 | 18.17 | |
| カラム3 | 18.82 | 17.79 | 18.74 | 17.20 | 17.84 | |
| RT+ | TD | FD | TC | TN | FN | NTC |
| カラム1 | 30.79 | 30.83 | 29.97 | 26.47 | 30.41 | 32.74 |
| カラム2 | 30.95 | 28.90 | 30.08 | 26.67 | 30.75 | |
| カラム3 | 30.44 | 30.83 | 30.21 | 26.50 | 30.47 | |
■FastGene™ RNA Basic kit : FD、FN
rps13 相対発現量
| DNA除去処理あり |
DNA除去処理なし |
|||||
| RT+ | TD | FD | TC | TN | FN | |
| カラム1 | 9.09E-01 | 1.30E+00 | 8.41E-01 | 2.14E+00 | 1.22E+00 | |
| カラム2 | 1.29E+00 | 1.41E+00 | 8.31E-01 | 1.88E+00 | 9.53E-01 | |
| カラム3 | 5.64E-01 | 1.30E+00 | 5.99E-01 | 2.10E+00 | 1.25E+00 | |
| RT- | TD | FD | TC | TN | FN | NTC |
| カラム1 | 3.35E-05 | 3.24E-05 | 6.48E-05 | 1.12E-03 | 4.56E-05 | 6.81E-06 |
| カラム2 | 2.94E-05 | 1.55E-04 | 5.96E-05 | 9.52E-04 | 3.45E-05 | |
| カラム3 | 4.44E-05 | 3.23E-05 | 5.36E-05 | 1.10E-03 | 4.34E-05 | |
■FastGene™ RNA Basic kit : FD、FN

一方、FastGene™キットのDNA除去処理なし(FN)は、DNA除去処理ありの各条件(TD、FD、TC)と同様にDNAの混入が極めて少ないことが示唆された。(赤囲み部分)

市販のRNA抽出キットにおいて、抽出したRNAサンプルへの「ゲノムDNAの残留」の程度は、初発サンプルの種類や、サンプル量などに依存します。
ゲノムDNA量と細胞数は相関するため、一般的には、初発サンプルに含まれる細胞数が多くなるほど、ゲノムDNAの残留の可能性は上昇します。
今回は、加用大地 様、神田真司 様のご厚意により、「FastGene™ RNA Basic Kitを用いた場合に特別なDNA除去処理行わなくてもDNAの混入が少なく、ダウンストリームであるqPCRの結果にほとんど影響が見られなかった事例」をご紹介させていただきました。
この場合、本資料中のデータでも示されているとおり、DNAを特異的に測定できる方法で残留ゲノムDNAをチェックすること、また、qPCRにおいて「逆転写を行わないコントロール」実験を並行して実施し、残留ゲノムDNAの影響をチェックすること、などの検証が重要となります。
なお、ゲノムDNAの残留が見られる場合や、ダウンストリームアプリケーションにおいて、ゲノムDNA残留のリスクを回避する必要がある場合には、プロトコールにDNaseI 処理が含まれているFastGene™ RNA Premium Kit のご使用をお奨めします。
- こちらのアプリケーションノートのPDFダウンロード : こちら
- アプリケーションノート検索ページ(型番・キーワード・アプリケーションから検索可能)




















DNaseI処理や付属のゲノムDNAカラムを用いることで他社キットはゲノムの影響を除く仕様になっており、処理できていた。
FastGene社のカラムであればこの処理を行わずともゲノムのコンタミネーションが他社のゲノムDNA除去カラム処理を行ったものと同等レベルまで少なく、RNA収量も十分であることがわかった。定量PCRの結果も安定している。
比較的安価であることも、FastGene™ RNA Basic Kitの大きなアドバンテージであると考えている。