日本ジェネティクスのテクニカルノートとは?
発売したばかりの新製品の性能評価や、既存製品の最適な条件を追求するための条件検討をすることでお客様に心からご納得頂いた上で商品をお使い頂けるよう、様々な評価試験を行っています。
採用前の検討資料として、または採用後の最適条件検討資料としてご活用ください。
また、当データに関するご質問はお気軽にページ下部のフォームよりお問い合わせください。
| テクニカルノート2019<02> 製品名:BluePippin用 Gelカセット High Pass Plus 10(Sage Science社) (Cat.No. BPLUS10) |
背景
ロングリードの次世代シーケンサでは、短鎖DNA断片を排除し、長鎖DNA断片を効率良く回収することが、シーケンスの成否に大きな影響を与えます。
BluePippinの“High-Pass”DNAサイズセレクションは、数kbp~数十kbp以上の長鎖DNA断片分離、回収に有効な手段として用いられてきました。
「High Pass Plus」は、High Pass DNAサイズセレクションで、より短時間かつ高収量を実現するために開発されたHigh Pass DNAサイズセレクション用ゲルカセットです。
本テクニカルノートでは、High Pass Plusカセットを用いたHigh Pass DNAサイズセレクションが従来法(High-Pass)とどのように異なるのか評価しました。
評価項目
① BluePippinでのラン時間
② 異なるサンプル、異なるインプットDNA量での回収量・回収率
製品仕様
| ゲルカセット | 今回の評価で用いた BluePippin設定 (Cassette Definition) |
製品の特徴と違い | |
| 従来法(High-Pass) | Pippin Gel Cassete 0.75% (Sage Science, BUF7510)   |
0.75% DF Marker S1 high-pass 15-20 kb |
• ゲルが細く、長い • 泳動距離が長く、分離能が良い。 特定サイズをピンポイントで取りたい時に有用 • 溶出ウェルの容量が40 μL • 15 kbp以上の分離・回収におよそ4 ~ 5 h |
|
High |
High Pass Plus Gel Cassete (Sage Science, BPLUS10)   |
15 kb High Pass Plus Marker U1 |
• ゲルが太く、泳動距離が短い構造 • High Pass Plus専用のCassette Definition(プログラム)によるサイズセレクションにより、長鎖DNAを高収量で回収 • 溶出ウェルの容量が80 μL • 15 kbp以上の分離・回収におよそ 2 h 30 ~ 3 h |
使用機器と使用試薬
• DNAサイズセレクション : BluePippin(BLU0001) ※ソフトウェアバージョン:v6.31-CD30
• Pippin Pulseゲル電気泳動: Pippin Pulse(パルスフィールド電気泳動パワーサプライ)(PPI0200)
Pippin Pulse用 10X KBB Buffer(KBB1001)
MidiPlus2 水平式電気泳動装置
(UVトレイ3種類、1mm厚 20サンプルコーム、UVトレイダム、
電極コード赤黒)(ME1571015)
DNA染色:Midori Green Direct(NE-MG06)
• 使用したサンプル : 細胞由来精製ゲノムDNA(細胞gDNA)
組織由来精製ゲノムDNA(組織gDNA)
 BluePippin |
 Pippin Pulse |
評価方法
細胞gDNAと組織gDNAを使用して15 kbp以上のサンプルを取得するため、BluePippinを用いてサイズセレクションを行った後に、Pippin Pulseを用いたパルスフィールド電気泳動にてバンドを確認した。
Ⅰ インプットDNAの分布を確認するため、各サンプルをPippin Pulseを用いてパルスフィールド電気泳動を行った。
Pippin Pulse設定(Pre-set protocols) :5-430 kb
泳動時間 :15時間
泳動バッファー :0.5×KBB buffer(Pippin Pulse泳動用バッファー)
Ⅱ 15 kbp以下の短鎖DNAを取り除くため、BluePippinを使用してサイズセレクションを行った。
Ⅲ 回収したサンプルが目的の長鎖DNAであることを確認するため、Pippin Pulseを用いてパルスフィールド電気泳動で確認した。(条件①と同じ)
Ⅳ 回収したサンプル1 μLをQubit 2.0フルオロメーター(Invitrogen:Q32866)で測定し、FDNA濃度を求め、長鎖DNA回収量を計算した。
結果
Ⅰ. Pippin Pulseゲル電気泳動によるインプットDNAの状態確認
 |
 |
M1・・・NEB Lambda PFG Ladder( #N0341S) M2・・・FastGene™ 1 kb DNA Ladder( #NE-MWD01) M3・・・Invitrogen 1 kb DNA Extension Ladder( #10511-012) |
| ①・・・・組織gDNA 300 ng ②・・・・細胞gDNA 300 ng |
||
|
サイズ分離する組織gDNA、細胞gDNAそれぞれには15 kbp以下のバンドが存在する。
• 組織gDNA:比較的gDNA分布がスメアで均一に分布しており、短鎖を多く含む。 |
||
| 0.75% アガロースゲル (0.5×KBB Buffer 120ml, アガロース0.9g) |
||
Ⅱ. BluePippinにおけるラン時間の比較
| ラン時間 |  |
|||
| 従来法 | 4 h 45 m 00 s | 約2時間差 | ||
| High Pass Plus | 2 h 31 m 40 s | |||
| High Pass Plusの方がラン時間が短く、迅速に分離、回収できた。 | ||||
Ⅲ. 異なるサンプル、異なるインプットDNA量での回収量・回収率
i) インプット量2 μgでのサイズセレクション
従来法とHigh Pass Plus(HPP)それぞれでインプット量2 μgで確認を行った
● Pippin Pulse ゲル泳動結果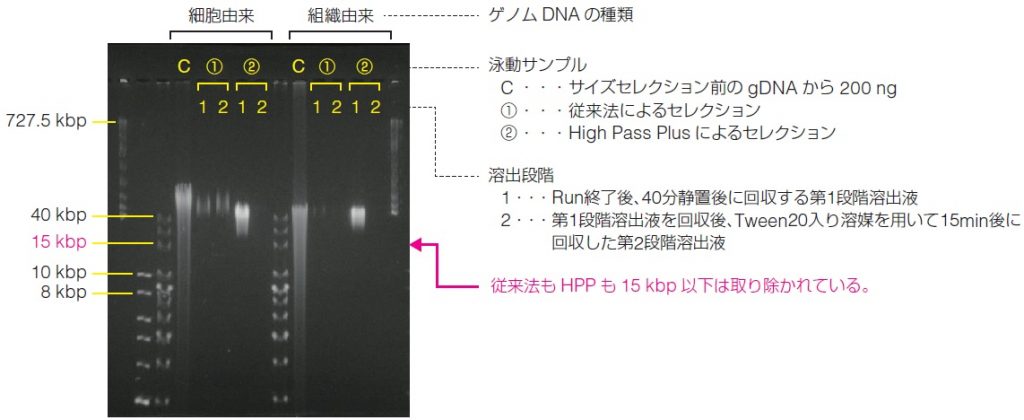
● ゲノムDNA インプット量 2 μg のときの回収量の比較
細胞gDNA回収量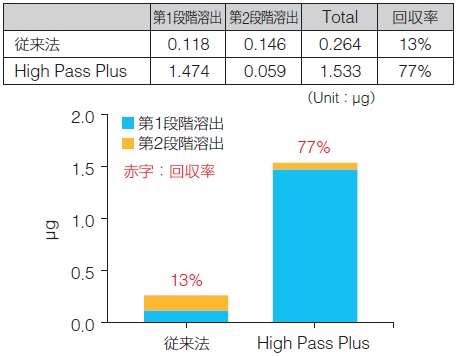 |
組織gDNA回収量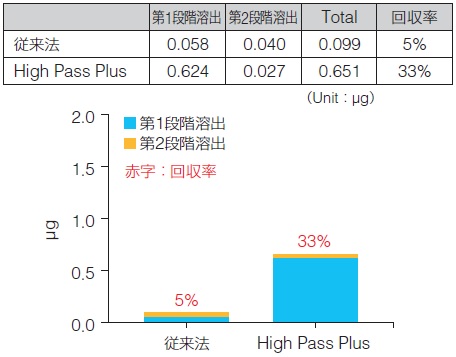
|
• 細胞gDNA回収率(77%)は組織gDNA回収率(33%)よりも高い回収率を示した。
→ この結果は、組織gDNAが短鎖DNAを多く含むこと(結果Ⅰ)に合致し、本実験におけるサイズセレクションが異なるDNAサイズ分布においても機能していることを意味している。
• High Pass Plusは、第1段階溶出液で抽出DNAのほとんどが回収できた。
ii) インプット量5 μgでのサイズセレクション
従来法とHigh Pass Plus(HPP)それぞれでインプット量5 μgで確認を行った
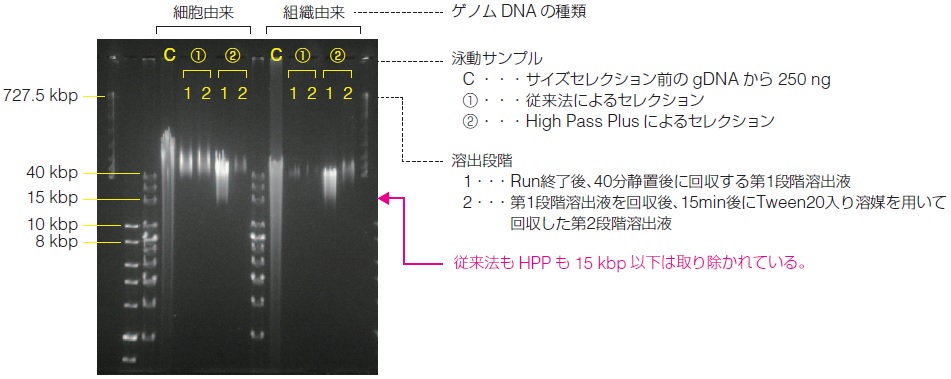
● Pippin Pulse ゲル泳動結果
● ゲノムDNA インプット量 5 μg のときの回収量の比較
細胞gDNA回収量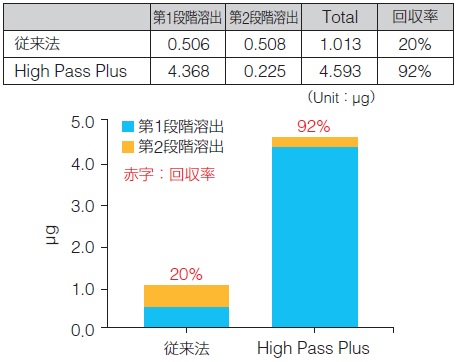 |
組織gDNA回収量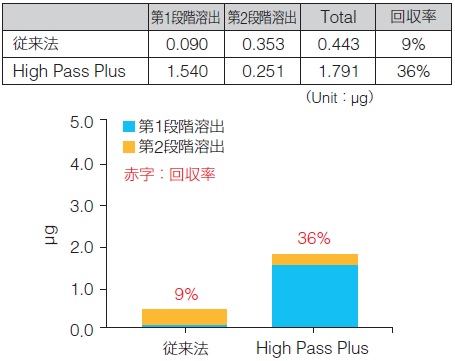 |
また、High Pass Plusは、インプット量2 μgの条件と同様に、第1段階溶出液で抽出DNAのほとんどが回収できた。
補足情報
第1段階溶出時点のDNA回収率の比較
今回得られた回収量・回収率の結果において、第1段階溶出時点での回収率を比較した。
※第1段階溶出時点のDNA回収率%=(1st 回収量/全体回収量)×100
| ゲノムDNAインプット量 | ゲルカセット | 細胞gDNA | 組織gDNA |
| 2 μg | 従来法 | 45% | 59% |
| High Pass Plus | 96% | 96% | |
| 5 μg | 従来法 | 50% | 20% |
| High Pass Plus | 95% | 86% |
いずれの条件でも、従来法と比較して、High Pass Plusは第1段階溶出時点で高い回収率が得られた。





















② 異なるサンプル(細胞由来と組織由来)、異なるインプットDNA量(2 μgと5 μg)いずれの条件でも、従来法(High-Pass)と比較してHigh Pass PlusのほうがDNAの回収量が顕著に増加した。