日本ジェネティクスのアプリケーションノートとは?
- 当社製品を実際にご使用頂いた、正真正銘、日本国内の研究者様による評価データ
- 製品をご検討中の方はもちろん、採用後であっても類似の研究をされている他の研究者の方の事例集としてご活用頂けます
- アプリケーション検索専用ページはこちら
| アプリケーションノート 2017<20> 製品名:KAPA3G Plant PCR キット(KK7251、KK7252) メーカー名:KAPA BIOSYSTEMS 社 製品名:MyTaqTM Plant PCR Kit(BIO-25055、BIO-25056) メーカー名:Bioline 社 |
下記データは、東京農業大学農学部農学科植物病理学研究室 キム オッキョン 様、佐藤 拓磨 様のご厚意により掲載させていただきました。
背景
植物ウイルスは作物や果樹などに広く発生し、多大な被害を及ぼすことで農業上問題となっています。さらに、植物ウイルス病に対して即効性のある農薬は未だにないため、発病が見られたら早期かつ正確に診断することが病害の蔓延を防ぐ最善策です。ウイルスゲノムとしてDNAをもつトマト黄化葉巻ウイルスは国内のトマト栽培に問題となっている病原ウイルスです。本ウイルスがトマトに感染・発症すると新しい葉の周辺部が巻き上がり、葉脈間が黄化してしまいます。さらに症状が進むと、葉はちりめん状となり萎縮状態となります。また発病した部位から上は、花が正常に咲かず、実もならないため、生育初期に感染した場合、収穫はほとんど見込めません。
当研究室では、このような感染した植物から病原ウイルスの同定を依頼されることも多く、感染が拡大しないように検査の正確さに加えて、スピード、手順の簡便さが求められています。従来の方法では、植物組織からDNAを抽出してウイルスの同定を行うため、時間を要し、手順も多いので課題となっていました。そこで植物組織を直接PCR反応液中に加えるダイレクトPCRにも使用できるPCRキットを検討しました。
ワークフロー
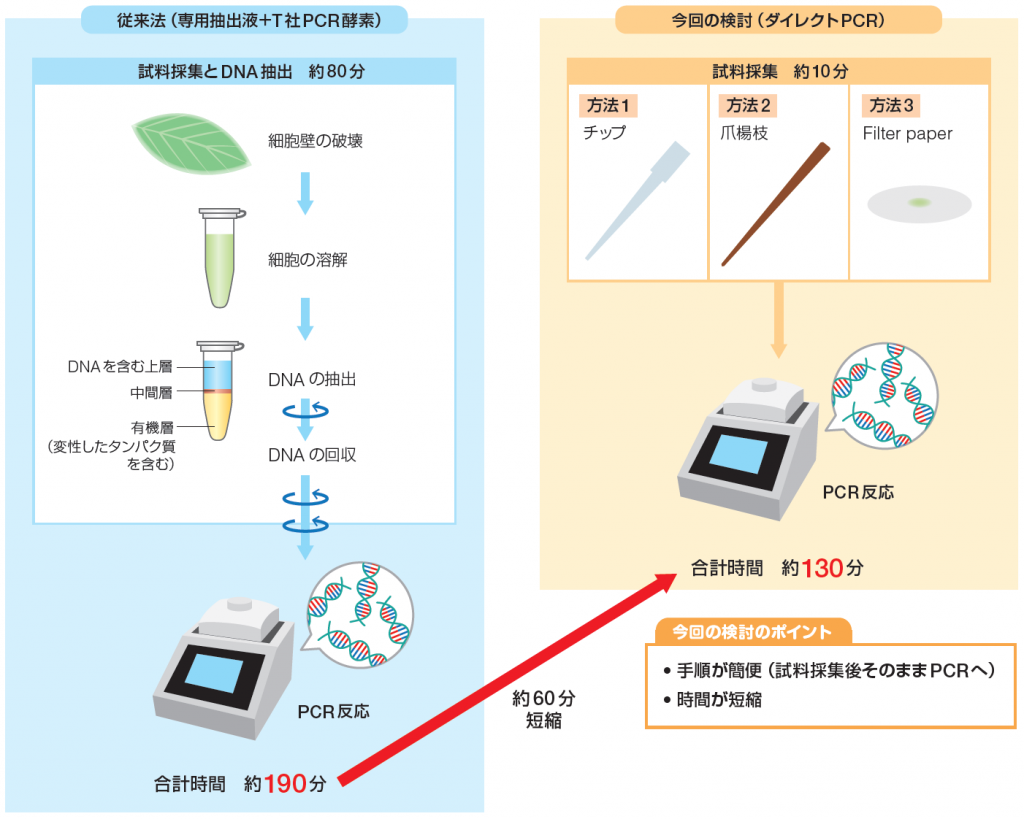
実験条件
● 試料採集とDNA抽出 約 80 分
1)細胞の破壊
| 凍結させた植物組織を粉末状に破砕 |
2)細胞の溶解
 |
← 試薬Ⅰを添加し懸濁 ← 試薬Ⅱを添加し転倒混和 65℃、10 分間 振とうインキュベーション 氷上、20 分間 |
3)DNAの抽出
 |
氷上から取り出す ← 抽出試薬を添加 室温、10 分間 振とう 遠心 1,300×g、10 min. DNAを含む上層を回収 (中間層は樹脂層、下層部は有機溶媒層) |
4)DNAの回収
 |
イソプロパノール(冷)を同量添加し転倒混和 遠心 4,000×g、5 min. 上澄みを除去 沈殿を70%エタノール(冷)で洗浄 遠心 4,000×g、5 min. 上澄みを除去 沈殿を10 分間、風乾 TEバッファーまたは水にてDNAの溶出 |
DNA溶出
● PCR条件
| 反応組成 | PCRプログラム |
||||
|
dH₂O 31.8 μL |
94℃ 94℃ 58℃ 72℃ 72℃ 15℃ |
2 min 1 min 1 min 1 min 2 min Hold |
|
|
|
*1 配列情報:
Deng et al.(1994), Detection and differentiation of whitefly-transmitted geminiviruses in plants and vector insects by the polymerase chain reaction with degenerate primers
●試料採集 約 10 分
● PCR条件
| 反応組成 | ||||
| ① KAPA3G Plant PCR Kit | ||||
|
dH₂O 17.6 μL KAPA3G Polymerase 0.4 μL |
 |
|||
| ② MyTaq™ Plant PCR kit ※MyTaq Plant PCR Mixは泡が生じやすいため、試料を加えた後にMyTaqを分注した |
||||
|
dH₂O 21.0 μL MyTaq Plant-PCR Mix(2X) 25.0 μL |
 |
|||
| PCRプログラム | ||||
| 94℃ 94℃ 58℃ 72℃ 72℃ 15℃ |
2 min 1 min 1 min 1 min 2 min Hold |
|
|
|
*1 配列情報:
Deng et al.( 1994), Detection and differentiation of whitefly-transmitted geminiviruses in plants and vector insects by the polymerase chain reaction with degenerate primers
*2
プロトコルに書いてある通りに、DNA抽出物からのPCRプログラムよりPCRサイクル数を増やして行った
結果
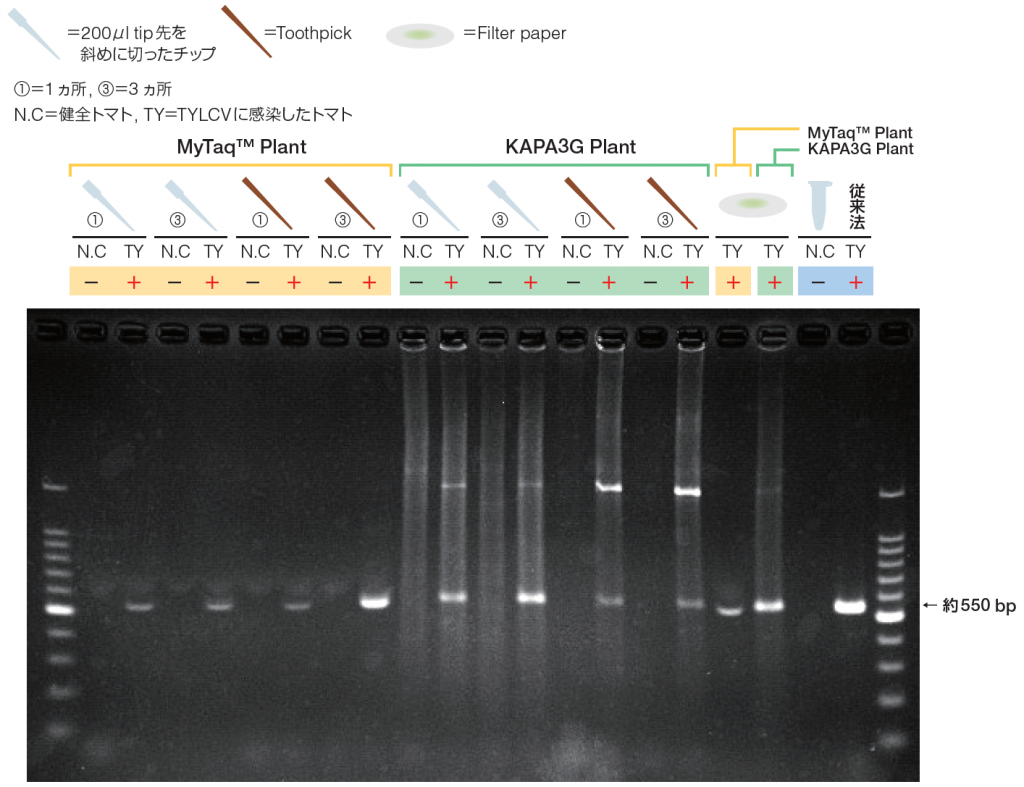 ■ 電気泳動条件
■ 電気泳動条件
1×TAE buffer
50 V, 40 min
1 μL of 6×loading buffer+5 μL of PCR product/lane
5 μL of 100 bp DNA ladder(TaKaRa社 Cat# 3407A)
予想通りにTYLCV感染葉からの試料全てで陽性反応が見られた。汁液の付いたFilter paperを入れてDNA増幅させた結果、MyTaqでもKAPA3Gでも陽性反応であったが、MyTaqを使った方はバンドが多少低く位置した。しかしながら、MyTaqで得たバンドをDNA精製、クローニングシークエンスを行ったところ塩基配列の決定には問題ないことが分かった。
全体的にKAPA3Gではスメーアが見られるが、MyTaqでは特異的反応のみが検出された。
チップを用いる場合は断片を取って反応液内に入れるのに苦労したが、爪楊枝を使うことでより簡易に核酸を得ることができた。1ヵ所を突いても病原ウイルスの検出には十分であったが、3 ヵ所を突いた方がより濃いバンドを得ることができた。
お客様のコメント

- こちらのアプリケーションノートのPDFダウンロード : こちら
- 製品情報詳細ページ: KAPA3G Plant PCR キット、
MyTaq™ Plant PCR Kit - アプリケーションノート検索ページ(型番・キーワード・アプリケーションから検索可能)

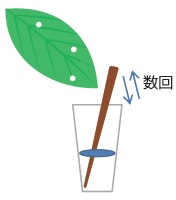



















試料採集においては、切断したチップ先を用いて植物葉をパンチする方法、爪楊枝で葉を突いて反応液内に解す方法、そして葉をFilter paperにブロッティングすることで汁液が付いたペーパーの破片を使う方法を試してみた。いずれの方法においても羅病葉からのみで陽性反応が見られたが、中でも爪楊枝法で最も簡易に核酸を得ることができた。爪楊枝法とMyTaq™ Plantキットの組み合わせにより、多検体の効率的な検定とともに、病原ウイルスを検定する研究において最も懸念されるコンタミネーションを防ぐこともできる。
今後、他の植物に発生しているDNAウイルスの検定にも有効であるかどうかの検討を進めていきたい。